TOP Research Publications Presentations Members RIH2S Link
研究テーマ
- 新規マクロファージ活性化機構の解明
- 瘢痕形成の無い創傷治癒を促す因子の探索
- ホヤグロビン遺伝子の進化
- ホヤ卵細胞質中に異所的に存在するATP合成酵素の機能と意義用
- ホヤ神経管形成の分子メカニズムと脊椎動物の進化
- 細胞のストレス応答の研究
[1. 新規マクロファージ活性化機構の解明]
これまでに確立した、マクロファージの貪食能を迅速かつ正確に定量できる評価系を用いて、血清に酵素処理を施したserum
MAFが素早く(10分以内)かつ高率に活性化できる分子メカニズムの解明を目指してきた。貪食能の活性化は、Actin細胞骨格の再編・集積によって生じるFrill様構造が形成されることで貪食の効率が上がることによりもたらせること、Frill様構造の形成には脂質ラフトの形成が必要であり、Annexin-A2やGalectin-3の発現や局在変化が必要となっていることを明らかにした。このシグナル伝達の過程をAnnexin-Galectin-Actin Axisと名付け、刺激後秒単位で生じる全く新しいマクロファージの活性化機構であることを明らかにした。
[2. 瘢痕形成の無い創傷治癒を促す因子の探索]
マクロファージの培養上清に角化細胞株の移動性と接着性を高める効果が見られた。マクロファージの培養条件を変えてもその効果は変わらず、serum-free培地で培養しても十分に効果を保っていること明らかにした。さらに培養上清を濃縮するとその効果がより顕著になることも明らかになってきた
[3. ホヤグロビン遺伝子の進化]
これまで高校生の研究サポートとしてJSTのROOTプログラムで行ってきた。その中でホヤグロビン遺伝子の進化に関わる研究を、当時高校生でプログラムに参加していた、神戸大学の学生を主著者とし、神戸大学や関西学院大学の先生方との共著論文をInternational Journal of Molecular Science誌に公刊した(2023, 24(21):16009)。
[4. ホヤ卵細胞質中に異所的に存在するATP合成酵素の機能と意義]
ミトコンドリアは,エネルギー生産に関わる細胞内小器官であり,ミトコンドリア内膜に存在するATP合成酵素複合体は,その中心となる分子です。しかし近年,この完全な複合体が内皮細胞や肝細胞の細胞膜上に存在し,それぞれアンギオスタチンやHDLの受容体として機能していることが示されています(Moser et al,
2001; Martinez et al, 2003)。
一方,ホヤ卵のマイオプラズムは筋肉細胞分化との関わりが指摘され,ミトコンドリアや色素顆粒の局在する細胞質ドメインとしてその機能が注目されてきました(図1)。そこに局在するタンパク質として,マイオプラズミン(Nishikata et al,
1987)が知られています。また,Nishida & Sawada (2000)により,筋肉細胞決定因子がERネットワークを含むマイオプラズム表層に局在する母性macho-1 mRNAであることが示され,母性mRNAの網羅的解析によりマイオプラズム表層に局在する母性mRNAが多数見つかってきました(Makabe et al, 2001)。これらはpostplasmic RNAと呼ばれています。
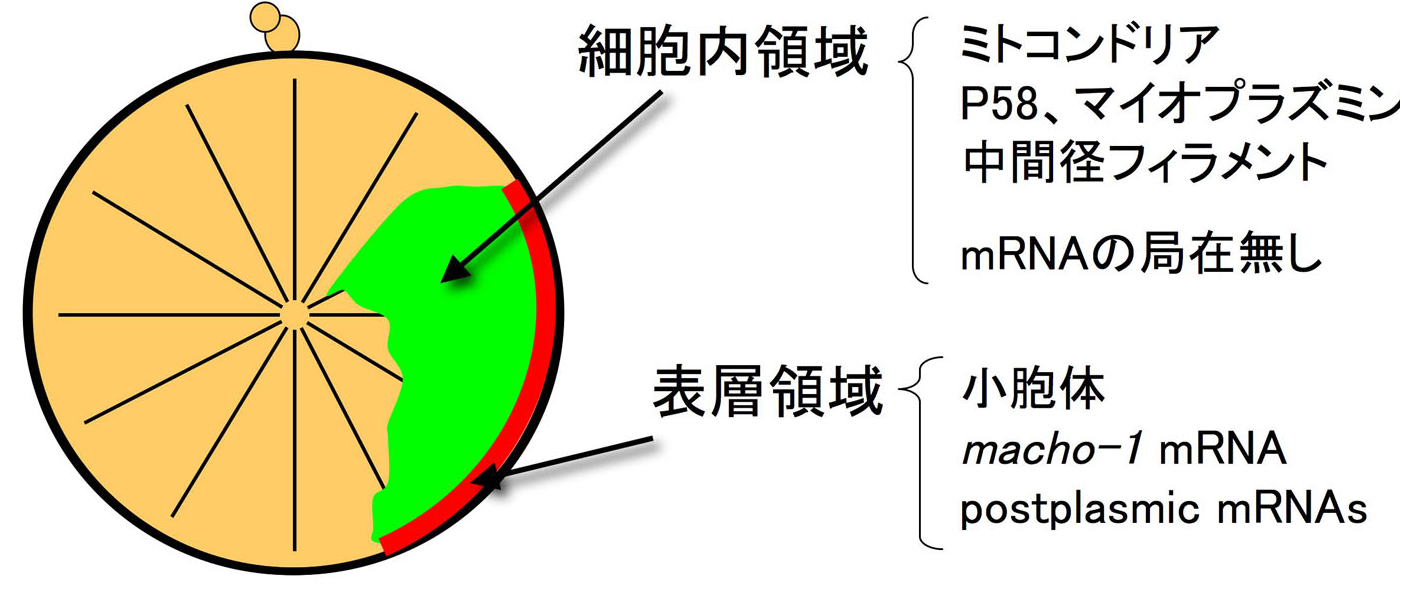
当研究室では,ATP合成酵素αおよびβサブユニットがこのマイオプラズムに局在することを示してlきました。図2にあるように,ミトコンドリア分画には,ATPα, ATPβ, MnSODが同程度検出されるのに対して,不溶性分画では,MnSODがほとんど検出されず,ミトコンドリアのコンタミがほとんど無いと考えられるにもかかわらずATPα, ATPβが相当量検出されています。さらに,受精卵での局在を調べてみると,ミトコンドリアの局在するマイオプラズム全体にATPα, ATPβおよびMnSODが局在しますが,ATPαおよびATPβは,MnSODとは異なり,表層により強い局在を示しています。これらの結果は,ATP合成酵素αおよびβサブユニットが,ミトコンドリア外の細胞質に存在し,それらは,マイオプラズムの表層下に局在していることを示しています。
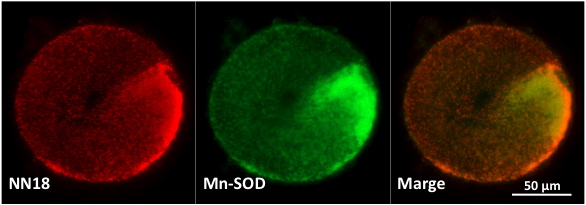
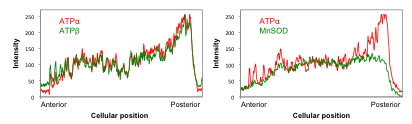
また,同じ局在を示すマイオプラズミンとαサブユニットがin vitroで結合することも示しており(Chiba et al, 1999),ATP合成酵素の一部がエネルギー生産とはまったく別の働きをしていると考えています。この,本来ミトコンドリア内で働くべきATP合成酵素が細胞質中に局在するという新奇な現象は,ミトコンドリアタンパク質の機能として大変興味深く,またさらに,ミトコンドリアと核との関係を考える上でも重要な知見であり,真核細胞の成り立ちにも示唆を与え得ると期待しています。
[5. ホヤ神経管形成の分子メカニズムと脊椎動物の進化]
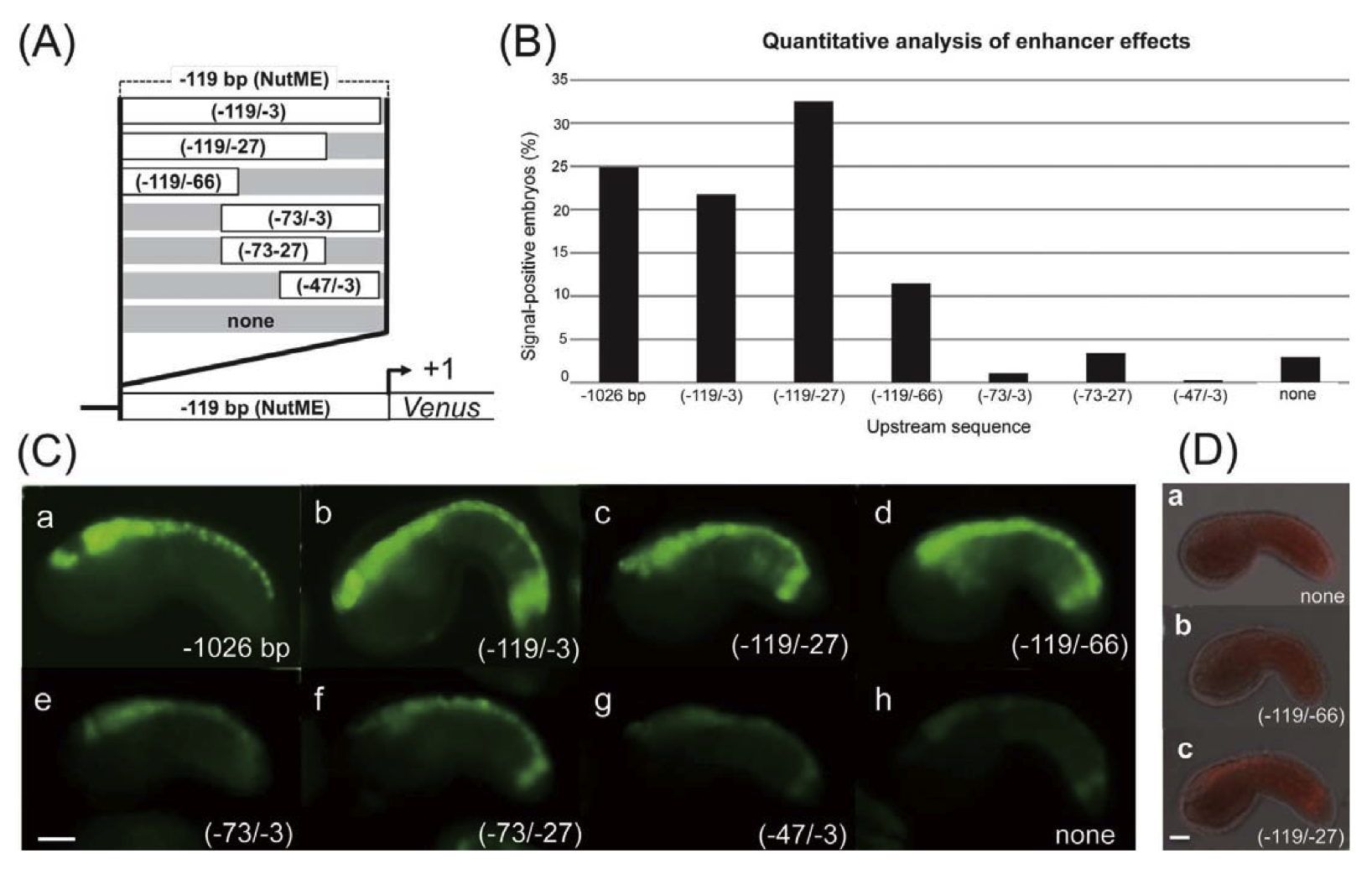
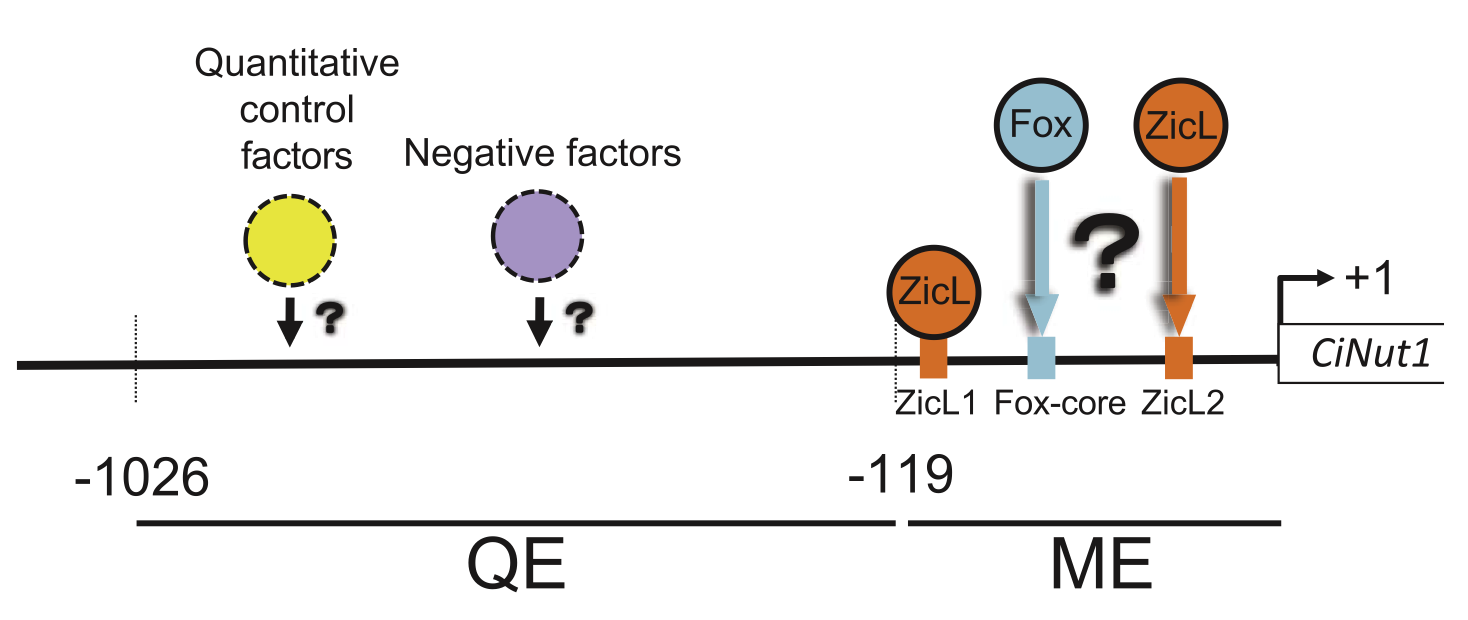
ホヤは,比較的単純な構造の神経管を持ち,ゲノム情報なども整備されていることから,神経管形成に必要な分子メカニズムを解析するための有用なモデル生物とされています。ホヤ神経管は,基本的には脊椎動物のそれと同じ構造をしています。当研究室ではこれまでに,のう胚期より発現が開始し,神経管形成過程において神経管全体で発現するCiNut-1遺伝子を報告し,CiNut-1遺伝子の神経管特異的発現調節メカニズムの解析を行いました。GFP(緑色蛍光タンパク質)レポーター遺伝子を用いた実験により,CiNut-1遺伝子の上流約1.0 kbで内在遺伝子の発現を再現できることがわかりました。さらに上流配列の欠失実験により,上流119 bpの配列でも神経管特異的発現が可能であることも示しました。この上流119 bpの配列には,2つのZicL結合サイトと1つのFox結合コア配列が見つかっています。近位のZicL結合サイト(ZicL1)に点突然変異を導入したところ,神経管特異的発現が消失しました。遠位のZicL結合サイト(ZicL2)やFox結合コア配列の重要性には,まだ不明瞭な点もありますが, ZicLが神経管全体での遺伝子発現をコントロールする重要な転写因子である可能性を示すことが出来ました。
この結果は,神経管形成過程のごく初期に必要な遺伝子が,ZicLというたったひとつの遺伝子の働きで転写活性化されることを示しており,脊索動物を特徴づける神経管という器官が進化の過程ではじめて獲得される際,ZicL遺伝子ひとつの働きの変化が大きく関わった可能性を示唆しています。
[6. 細胞のストレス応答の研究]
細胞死には複数のタイプが知られていますが,大別するとアポトーシスとネクローシスに区別されます。アポトーシスとは,アポトーシス関連遺伝子の働きにより細胞自身が能動的に細胞死を誘導するもので,ゲノムDNAの断片化,核および細胞質の断片化がその形態的特徴です。一方ネクローシスに関しては,細胞内小器官や細胞が膨潤し,次第に細胞境界が不明瞭になっていくといった形態変化を示すといわれていますが,研究者によっていくつもの名称やタイプ分けがあり,まだまだよくわからないことが多いのです。
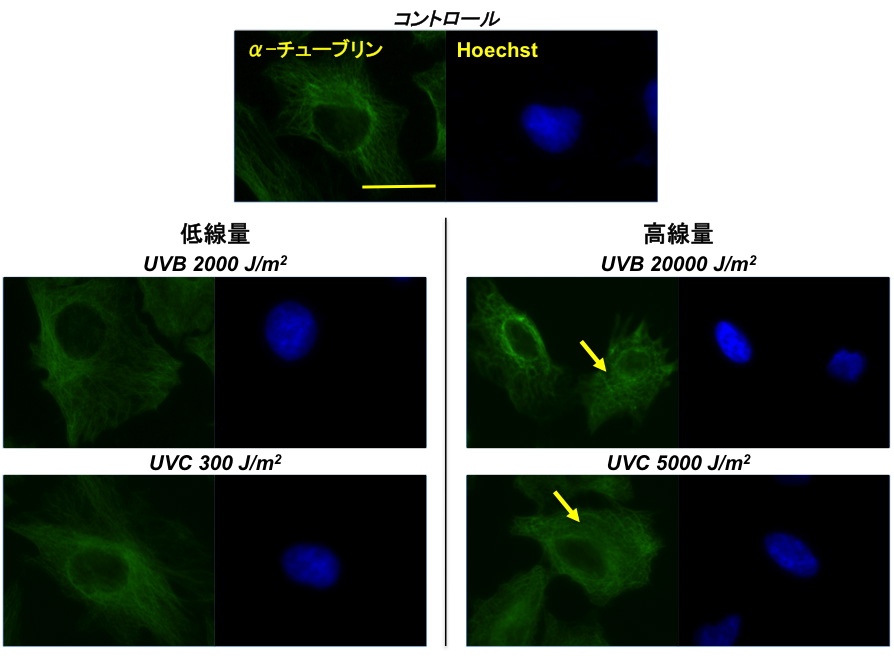
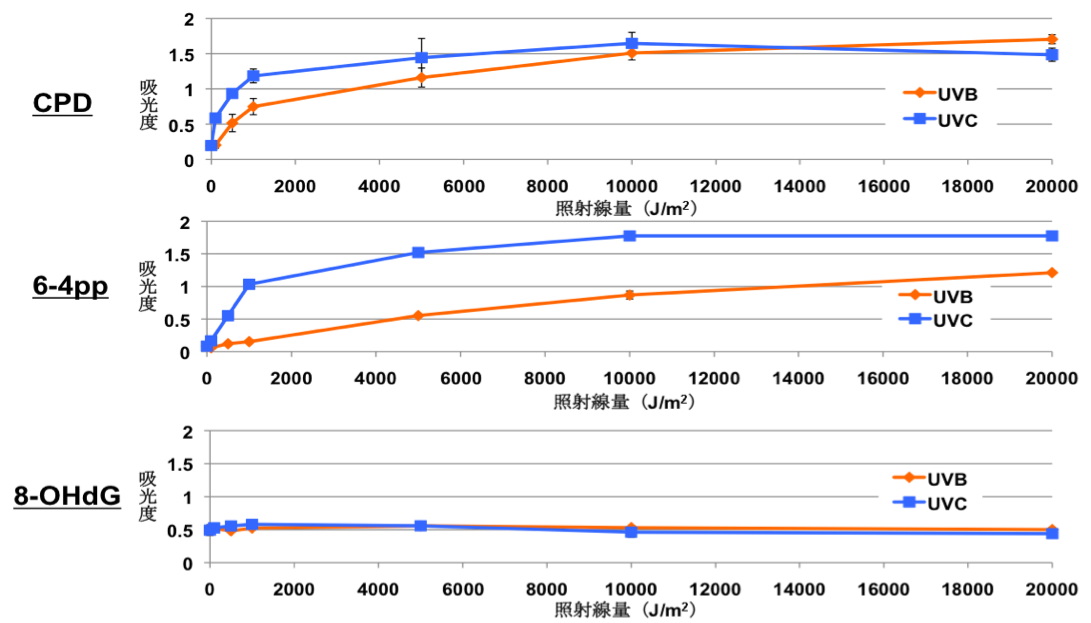
一方紫外線は,線量によって異なるタイプの細胞死を誘導することが知られています。そこで,線種の異なる紫外線でそれぞれ線量を変えて照射し,誘導される細胞死を分類し,細胞死の選択に関わる要因を明らかにしようと試みました。UVBおよびUVCをHeLa細胞に照射し,細胞形態の観察,カスパーゼ活性の評価およびカスパーゼ阻害剤による細胞死回避の評価を行いました。すると,線種に関わらず,低線量ではアポトーシスが,高線量ではネクローシスが誘導されることが分かりました。さらに線量ごとに生じるDNA損傷の定量化を行ったところ,UVBでもUVCでもアポトーシスを生じ始める線量では同程度のCPD(シクロブタン型ピリミジン二量体)が生成されており,また同様にネクローシスを生じ始める線量でも同程度のCPDが生成されていました。これは,アポトーシスやネクローシスといった細胞死実行経路を細胞が選択する際, DNA損傷のひとつであるCPDの生成量が深く関わっていることを示唆しています。このように統一的な条件で2つの細胞死を比較することが可能な実験系を用いることにより,細胞死の分類を明確にすることも可能になると期待されるとともに,細胞死選択に関わる分子メカニズムの解明に貢献できるものと期待されます。