長濱研究室では、高分子科学および細胞工学に立脚したモノづくりを基盤として、新しい医療・治療技術を生み出すための研究を展開しています。現在は、主に3つの研究テーマを進めています。
(1)細胞をゲル化する技術の開発、組織再生技術への応用展開
細胞は生命体を構成する基本素材であり、時間プログラムされた細胞分裂、自己増殖、接着や組織化などの動的応答、分化による形質転換など、人工素材(材料)では達成できない数多くの賢い機能や応答を示します。これまでに、科学者達は細胞の賢い機能や応答に注目して研究を行ってきました。例えば生物学者は、細胞の構造、細胞の機能発現の仕組み、細胞から生命体の発生、細胞の異常化の仕組み、病気が起こる仕組みなどについて研究してきました。また、医学者や薬学者は、生物学者が解明した知見をもとに、細胞の機能や応答を制御する技術や薬を開発することで、感染症治療、がん治療、再生医療など様々な治療技術を開発し、医療を進展させています。では、化学者はどのように細胞研究に貢献してきたのでしょうか。一つの流れとして、1990年代に化学者は、有機化学的手法により細胞反応の仕組みを解明する学問領域ケミカルバイオロジーを発展させました。一方、材料化学分野では、細胞をうまく活用した研究がいまだ行われていないのが現状です。
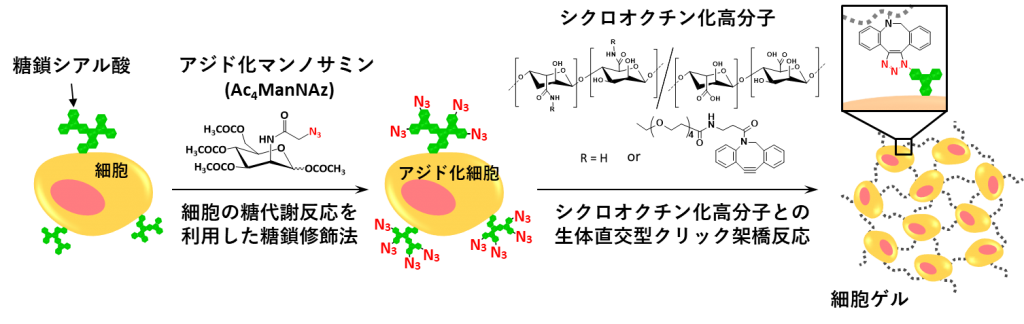
このような背景のもと、当研究室では、細胞を「賢い化学素材」と捉え、細胞を材料開発のためのビルディングブロックとして利用するアイデアを考案しました。つまり、細胞を賢い化学素材として用いて“生きている細胞材料”を創ることに挑戦しました。また、細胞がもつ様々な賢い機能や応答を起源として、生きている細胞材料にユニークな機能を発現させることにも取り組んでいます。本研究では,次の手法により生きている細胞材料を作製します(下図)。①細胞が本来もっていない官能基であるアジド基を化学修飾したマンノサミン(アジド化マンノサミン)を合成し、細胞の培養液に加えて培養することで、細胞の糖代謝反応により細胞膜タンパク質の糖鎖シアル酸にアジド基が導入されます。②アジド基と触媒なしでクリック反応可能なシクロオクチン基を生体適合性高分子に導入します。③アジド化細胞をシクロオクチン化高分子により生体直交型クリック化学架橋させることにより、細胞を架橋点とする高分子ゲルネットワークを作製します。実際に、ヒト細胞を含む様々な種類のほ乳類細胞の培地にアジド化マンノサミンを与えて培養すると、細胞膜タンパク質にアジド基を導入することができました。生体適合性を有するアルギン酸と分岐型ポリエチレングリコールを反応させて分岐型アルギン酸を合成し、さらに分岐型アルギン酸とアミノ化シクロオクチン基を反応させ、側鎖に複数のシクロオクチン基を導入した分岐型アルギン酸を合成しました。アジド化細胞のペレットをシクロオクチン化分岐型アルギン酸水溶液で均一になるまで懸濁してクリック反応させたところ、細胞数とシクロオクチン化分岐型アルギン酸の濃度が適切な条件において、速やかにバルクサイズのハイドロゲル(以降、細胞ゲルと表記します)を形成しました。細胞を主成分とするゲルの開発例はこれまでになく、本研究が世界初の報告です。
重要なこととして、アジド化細胞とシクロオクチン化分岐型アルギン酸の懸濁液をマウス皮下に注射投与すると、注射部位で速やかにゲルを形成したことから、細胞ゲルはインジェクタブルゲルとして利用できることが示されました。細胞ゲル内の細胞は数か月後も高い生存率を維持しており、また高い増殖性を示しました。
細胞ゲルをコラーゲン修飾シャーレ(細胞接着性シャーレ)およびMPCポリマー修飾シャーレ(細胞非接着性シャーレ)上で培養すると、MPCポリマー被覆シャーレ上で培養したゲル表面の細胞はシャーレに接着しませんが、コラーゲン被覆シャーレ上で培養したゲルでは、大部分の細胞がシャーレに接着しました。これより、細胞ゲル表面に存在する細胞は「足場の性質を識別して接着特性を変化させる」細胞本来の応答性を示すことが分かりました。興味深いことに、MPCポリマー被覆シャーレ上で培養した細胞ゲルは、シャーレを傾けると速やかに流れ落ちましたが、コラーゲン被覆シャーレ上で培養した細胞ゲルは傾けても流れ落ちず、さらに強い物理刺激を与えてもシャーレに接着した状態を維持しました。つまり、細胞ゲル表面に存在する細胞の接着反応を活かすことで、ゲルそのものに基質選択的接着機能を付与できることが明らかになりました。これは、細胞ゲル内の細胞が示す機能や応答を、ゲルネットワークを介して情報変換し増幅することで、ゲル全体の新しい機能として発現させることの成功例であり、本研究が世界初の報告です。
上記のような細胞ゲルの特長は再生医療に相応しいため、細胞ゲルの再生医療への応用を検討しました。ヌードマウスの大腿筋(骨格筋)損傷モデルを作製し、損傷部位に筋芽細胞架橋ゲルを注射投与すると、2週間後には損傷した骨格筋組織の再建が確認でき、下肢筋力の効果的な回復も見られました。従来の細胞移植手法(アルギン酸ゲル内に筋芽細胞を物理的に内包して移植する)およびMatrigelを用いた筋芽細胞移植と比べて、細胞ゲル移植は有意に高い骨格筋再生効果を示しました。これより、細胞ゲルは生体に低侵襲な画期的な細胞移植・組織再生技術として、再生医療分野への貢献が期待されます。様々な細胞をゲル化できるため、今後は細胞ゲル技術を様々な細胞・組織の再生医療へと応用展開したいと考えています。
Y. Kimura, S. Aoyama, N. Ueda, T. Katayama, K. Ono, K. Nagahama*
Covalent cell-loading injectable hydrogel scaffold significantly promotes tissue regeneration in vivo compared with a conventional physical cell-loading hydrogel scaffold
Advanced Biology, in press.
K. Nagahama*, Y. Kimura, A. Takemoto
Living functional hydrogels generated by bioorthogonal cross-linking reactions of azide-modified cells with alkyne-modified polymers
Nature Communications, 9, 2195 (2018).
(2)Scarlessな組織修復(再生)技術の開発
現在の細胞移植治療では、細胞を生理食塩水などに懸濁して再生(修復)させたい部位に注射投与することが一般的です。例えば、関節軟骨を損傷した患者へ間葉系幹細胞を移植する治療では、細胞懸濁液を損傷部位へと注射投与し、10分程度静置圧着することで関節部位への細胞生着を促進します。しかし、関節という閉鎖空間にも関わらず、移植細胞の約40%は生着せずに流出・壊死することが報告されています。一方、心不全患者への心筋細胞移植の場合、心臓は胸腔という体液に富む開けた空間に位置するため、移植細胞は容易に流出し、生着率は約10%と低いのが現状です。細胞懸濁液による移植で生着率が低い原因は、移植細胞の流出だけではなく、移植細胞が生着するための足場を提供していないことも重大な問題です。
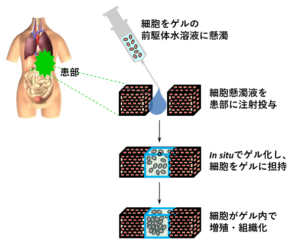
細胞移植治療により組織や臓器の機能回復を達成するためには、①移植した細胞を患部に留めること、②移植した細胞が生存していること、③移植部位で細胞が増殖・三次元組織化し機能発現すること、が必要です。そこで、従来の細胞移植治療の問題であった生着率向上を達成するための有望な手法として、インジェクタブルゲルが提案されています。インジェクタブルゲルは、生体外では溶液ですが、体内に投与された後はゲルへと状態変化する物質です。インジェクタブルゲルを用いて細胞移植を行う場合、ゲルの前駆体水溶液で細胞を懸濁し患部に移植すると、in situでゲル化して細胞がゲル内に担持されるため、細胞を患部に高効率で留めることができます。また、ゲルネットワーク構造が細胞の足場として機能すれば、移植細胞の増殖や組織化、機能発現が見込まれます(下図A)。これまでに、多数の合成高分子からなるインジェクタブルゲルが報告されており、移植細胞を患部に長期的に留めることは可能になりました。しかし、ゲルは合成高分子から構成されており、ゲルの内部環境は生体本来の生物学的環境とは大きく異なるため、ゲルに内包した間葉系幹細胞の増殖性は低く、組織化には至っていません。
この問題点を解決するため、インジェクタブルゲルの内部を生体本来の生物学的環境に近付け、ゲルを足場として機能させることを目指した研究が始まりました。その中でも特に、細胞外マトリクスを構成するコラーゲン(ゼラチン)やヒアルロン酸をなど主成分として用いたインジェクタブルゲルの研究が盛んに行われており、合成高分子のみから構成されるインジェクタブルゲルと比べると組織再生効果は向上したものの、満足のいく再生は得られておりません。
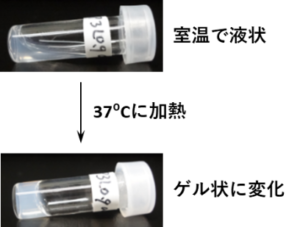
このような研究結果から、当研究室では、単に細胞外マトリクス成分の種類を増やしてゲルを作製することは有効ではなく、用いる細胞外マトリクス成分の種類、その組成、そしてそれらの相互作用を意識したゲル組成・構造の最適化が必要であると考えています。しかし、生体で見られるような複雑で階層的な細胞外環境をゲル内に人工的に構築することは、現在の科学技術では難しいことも事実です。そこで、当研究室では、新しいアイデアとして「生体がもつ力を利用することで、移植細胞に最適な細胞外微小環境を生体内でゲル内部に自発的につくらせる」ことを考案しました。具体的には、細胞外マトリクスや増殖因子などのタンパク質を非特異的に吸着・保持する成分と、生分解性ポリマーの二成分を複合したインジェクタブルゲルです。この複合型インジェクタブルゲルを体内に投与した場合、初めのゲル主成分である生分解性ポリマーが体内で加水分解されて分解産物がゲル外に溶出し、これに同調して生体内の細胞外マトリクスや増殖因子などが吸着・保持されることにより、ゲルの構成成分が生分解性ポリマーからホスト由来の細胞外マトリクス成分や増殖因子に置き換えられると期待されます(下図B)。これにより、生体内で見られるような複雑性をもつ細胞外微小環境がゲル内部に自発的に構築されれば、移植細胞の増殖や組織化・機能発現を効率よくサポートすると見込まれます。ゲル構成成分として、化学合成により得られる生体適合性の生分解性ポリマーであるpoly(D,L-lactide-co-glycolide)-b– poly(ethylene glycol)-b-poly(D,L-lactide-co-glycolide)(PLGA-PEG-PLGA)を用いました。また、水素結合や静電的相互作用などによりタンパク質や多糖など高分子電解質を強く吸着する特性をもつクレイナノ粒子であるLAPONITEを用い、これら二成分の複合インジェクタブルゲルを作製しました。本手法では、PLGA-PEG-PLGAとLAPONITEを適した組成で複合することにより、室温と体温間にゾル-ゲル転移を示すことから、インジェクタブルゲルとして適した感温性を有すると言えます(下図C)。
複合ゲルにヒト皮膚線維芽細胞(HDF),ヒト臍帯静脈内皮細胞(HUVEC),ヒト脂肪由来幹細胞(ADSC),マウス筋芽細胞(C2C12)などを内包し、in vitroで2週間培養したところ、PLGA-PEG-PLGA単独ゲル内で細胞はほとんど増殖しなかったのに対して、複合ゲル内部では顕著な細胞増殖を示しました。この結果から、PLGA-PEG-PLGA単独ゲルでは構成成分の置換が起こらず、内包した細胞に足場を提示することができなかったのに対して、複合ゲルではゲル構成成分が培地中の活性タンパク質に置換され、幅広い種類の内包細胞に足場を提供したと示唆されます。また、その細胞増殖率はポジティブコントロールとして用いたMatrigelよりも高いものでした。
本複合インジェクタブルゲルを用いた細胞移植による組織再生および治療効果を調べるため、神経、血管、リンパ管を含む大腿筋の骨格筋組織を切除したモデルマウスを作製し、そこに本インジェクタブルゲルを用いてC2C12細胞を移植しました。ネガティブコントロールとして、PBSもしくはPLGA-PEG-PLGA単独ゲルでC2C12細胞を懸濁して移植しました。ポジティブコントロールとして、MatrigelでC2C12細胞を懸濁して移植しました。小動物握力測定装置を用いてマウスの筋力回復を調べたところ、ネガティブコントロールでは細胞が筋損傷部位に生着しないため筋力の回復が見られないどころか、血管やリンパ管も再建されないため浮腫・潰瘍・壊死が生じました。Matrigelでは7日後から筋力が回復し始め、15日後には元の約60%にまで筋力回復しました。それに対して、複合ゲルでは早い段階から持続的な回復を示し、15日後には元の90%にまで回復しました。初期段階からの効果的な回復は、ゲルの分解に伴って起こる生体由来の細胞外マトリクスや増殖因子などの吸着・固定化によりもたらされたと考えています。複合ゲル移植15日後のマウス大腿筋組織を開いて観察したところ、損傷部位にはきれいに筋肉が形成され、周辺筋組織との境目なく連続した骨格筋組織になっていました。つまり、適切な治療を行わないと壊死に至るような大きな筋損傷に対して、複合ゲルを用いた細胞移植は明確な治療効果を示しました。
以上のように、当研究室で開発した『生体内で患者さん由来の細胞外マトリクスにより成分置換され、活性状態になるインジェクタブルゲル』は、既存のインジェクタブルゲルの性能をはるかに上回っており、細胞移植と移植細胞への足場提供を同時に満たすゲル材料であることが示されています。このPLGA-PEG-PLGA/LAPONITE複合ゲルは、移植した生体内の部位に豊富に存在する細胞外マトリクスや増殖因子を吸着・保持してゲル内環境を整えるため、理屈的にはすべての生体組織において移植細胞に適したゲル内環境を与えることが可能であり、すべての生体組織の再生に適用できるものと期待しています。今後は、このゲル技術を様々な細胞・組織の再生医療へと応用展開したいと考えています。

図(B)生体成分により置換されるPLGA-PEG-PLGA/LAPONITEインジェクタブルゲルの概念図
図(C)PLGA-PEG-PLGA/LAPONITE複合溶液の体温に応答したゲル形成
K. Ono, Y. Sanada, Y. Kimura, S. Aoyama, N. Ueda, T. Katayama, K. Nagahama*
A thin hydrogel barrier linked onto cell surface sialic acids through covalent bonds induces cancer cell death in vivo
Biomaterials Science, 8, 577 (2020).
N. Oyama, H. Minami, D. Kawano, M. Miyazaki, T. Maeda, K. Toma, A. Hotta, K. Nagahama*
A nanocomposite approach to develop biodegradable thermogels exhibiting excellent cell-compatibility for injectable cell delivery
Biomaterials Science, 2, 1057-1062 (2014).
(3)細胞核への物質輸送技術の開発
細胞核は遺伝情報の保持・複製、遺伝子発現など細胞の運命を決定する反応場であるため、核内の分子を標的とする医薬や転写制御物質などの機能物質を核内輸送することで、人為的な細胞の運命制御が期待できます。核内に機能物質を輸送するためには、核膜孔を効率よく突破するキャリアが必要となりますが、そのようなキャリアはいまだ開発されていません。そこで、当研究室では、自ら核膜孔を突破して核内へと移動するナノキャリアを開発し、細胞核への物質輸送による細胞運命制御技術に応用することを目指し、研究を展開しています。
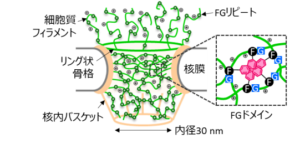
核膜孔は約30種類のヌクレオポリンが集合したチャネル状構造体です(下図A)。チャネル内部と細胞質フィラメントのヌクレオポリンはフェニルアラニン(F)とグリシン(G)の繰り返し配列(FGリピート)を多くもっており、特にチャネル内部のFG部位は、F残基の側鎖ベンゼン環同士の疎水性相互作用やπ-πスタッキングを駆動力として会合し、形成されたFGドメインが物理架橋点となることで、ゲル状ネットワーク構造をとります。また、FGリピート間には塩基性アミノ酸が多く含まれることが報告されています。これにより、核膜孔のゲル状ネットワーク構造は分子ふるい効果を示し、厳密なバリア機能を発現します。このバリア機能により、タンパク質の多くは単独で核膜孔を通過できないため、核内で機能するタンパク質は輸送体であるインポーチンにより核内へ運ばれます。核内へ運ばれるタンパク質は核移行シグナル配列をもっており、インポーチンαが核移行シグナル配列と結合し、インポーチンβはインポーチンαと結合して三者複合体を形成します。インポーチンβは疎水ポケットを複数個もっており、また酸性アミノ酸を比較的多く含んでいます。この三者複合体が核膜孔を通過する際、静電相互作用や疎水性相互作用によりインポーチンβが細胞質フィラメントと結合し、その後はチャネル内部のFGドメインと多点で動的に結合・解離を繰り返し、ネットワーク構造を部分的に解きながら核内に侵入することが知られています。
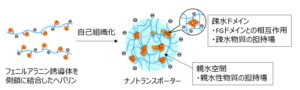
当研究室では、核輸送キャリアをde novo設計する上で、インポーチンβの核膜孔通過メカニズムに倣い、FGリピートやFGドメインと多点で動的に結合・解離する疎水ドメインを複数もつ酸性のナノ構造体を設計すれば、核膜孔通過能を発現するのではないかと考え、酸性多糖ヘパリンの側鎖にフェニルアラニン誘導体を結合した両親媒性高分子を合成しました(下図B)。この疎水化ヘパリンは疎水性相互作用などにより自己組織化し、ナノ構造体を形成すると考えられ、疎水ドメインはFGリピートやFGドメインとの相互作用や疎水性薬物の担持場として、親水空間はタンパク質や核酸など親水性物質の担持場として機能することを期待しています(下図C)。
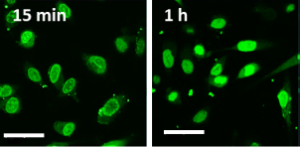
実際に、疎水化ヘパリンをPBSや細胞培養液に分散すると粒径が約6 nmのナノ構造体を形成しました。これは核膜孔の内径(30 nm)よりも十分に小さいサイズです。また、ナノ構造体は負電荷表面を示しました。FITC標識ナノ構造体をエレクトロポレーションによりHeLa細胞の細胞質へ導入すると、15分後には核膜周辺に集まりはじめ、1時間後には大部分が核内に移行・集積したことより(下図D)、インポーチンを模倣して設計したナノ構造体は核膜孔通過能をもつことが示されました。また、ナノ構造体は脳、筋肉、皮膚など組織レベルでも細胞核に移行・集積し、様々な種類の細胞や組織に適用できることが示されました。
ナノ会合体には抗がん剤やバイオイメージング用蛍光色素、またタンパク質や核酸などの機能物質を担持できました。さらに、機能物質@ナノ構造体を細胞質に導入すると、機能物質はナノ構造体により核内へと運ばれることを確認しています。また、核内で機能物質はナノ会合体から徐々に放出され、機能発現することも見出しました。以上の結果より、当研究室で設計したナノ構造体は、細胞核へ物質を輸送し核内で機能発現させる細胞核ナノトランスポーターであることが実証されました。
今後は核内輸送物質として、ペプチド・オリゴ核酸など中分子化合物、また遺伝子発現に関わるプラスミドDNAや転写因子などにも展開し、本ナノトランスポーターを発展させることにより、疾患治療や再生医療など医療全般に有用な細胞核ドラッグデリバリー技術を生み出すことを目指し、本研究を進めていきます。
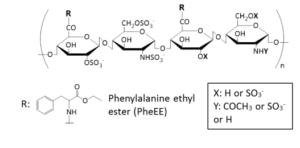
図(B)細胞核トランスポーター分子の構造
図(C)トランスポーター分子が自己組織化により形成するナノ構造体
図(D)核膜付近に集まったナノ構造体(左)、核内移行・集積したナノ構造体(右)
K. Nagahama*, Y. Sano, M. Inui, S. Aoyama, T. Katayama, K. Ono
Bioinspired cell nuclear nanotransporters generated by self-assembly of amphiphilic polysaccharide-amino acid derivatives conjugates
Advanced Biosystems, 4, 1900189 (2020).